Testes disponíveis:
Reação em cadeia de polimerase (PCR)
- Detecta a presença de uma sequência específica de ácido nucleico viral (RNA).
Tipos de amostras: tecidos intestinais, fezes, esfregaços retais, fluidos orais, etc. - Prós:
- Sensibilidade muito alta (pode detectar pequenas quantidades de vírus).
- Detecção precoce: os casos agudos devem ser positivos.
- Muitos tipos diferentes de amostras podem ser usados (tecidos intestinais, fezes, esfregaços retais, fluidos orais, etc.)
- Custo moderado:
- Muitas vezes, 10 amostras de fezes/esfregaço ou tecido intestinal podem ser combinadas para reduzir custos e minimizar a perda de sensibilidade.
- As amostras de fluido oral normalmente não são agrupadas porque o valor Ct (número de ciclos necessários para amplificar o RNA viral a um nível detectável) será maior (porque as concentrações de vírus são mais baixas), o que pode resultar em uma perda significativa de sensibilidade.
- Contras:
- O sequenciamento é necessário para diferenciar o vírus da vacina da infecção por vírus de campo.
- A contaminação ambiental pode gerar muitos resultados positivos: os suínos infectados eliminam grandes quantidades de vírus.
Ensaio imunoabsorvente enzimático (ELISA)

- Detecta a presença de anticorpos.
Tipos de amostras: soro, fluidos orais. - Prós:
- Os animais permanecem positivos durante várias semanas, especialmente IgA em fluidos orais.
- Pode ser usado em casos crônicos.
- Contras:
- Pode haver diferenças na detecção entre diferentes testes.
- Demora entre 7 e 14 dias para os animais se tornarem soropositivos.
- Não diferencia entre anticorpos maternos e aqueles provenientes da exposição.
- Não faz distinção entre vacinação e infecção por vírus de campo.
- É melhor ter um ELISA que detecte os níveis de IgA, especialmente em fluidos orais.
Imunohistoquímica (IHC)
- Detecta a presença de antígeno viral.
- Tipos de amostras: tecidos intestinais.
- Prós:
- Detecta o vírus no local da lesão (boa prova de causalidade).
- Permite diferenciar entre quantidades baixas, moderadas e altas de vírus presentes.
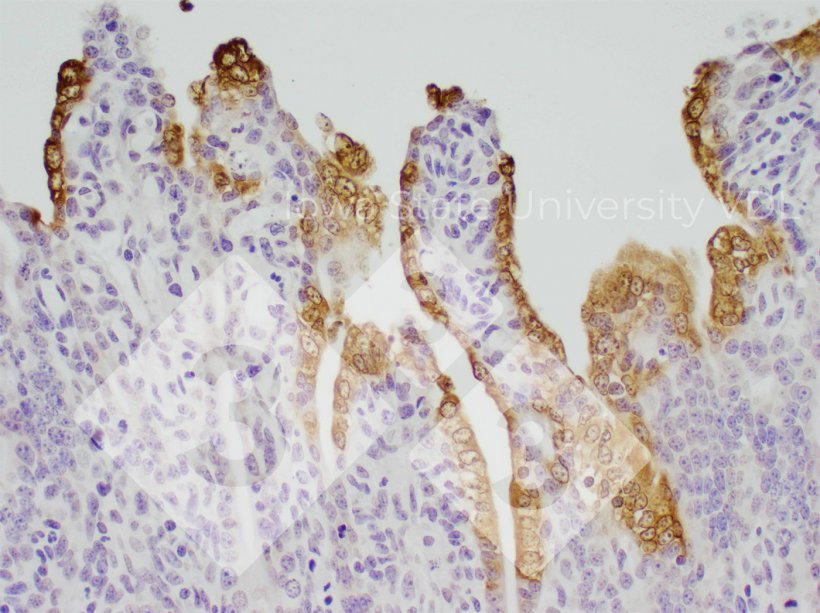
- Contras:
- A amostra de tecido correta deve ser enviada.
- Requer uma quantidade significativamente maior de vírus do que o PCR.
- Ele testa apenas uma pequena quantidade de tecido.
- Nos leitões, as vilosidades intestinais são rapidamente destruídas, resultando em alterações drásticas na quantidade de vírus presente (coloração) em apenas 2 dias.
Anticorpos fluorescentes indiretos (IFA)
- Detecta a presença de anticorpos.
- Tipos de amostras: soro.
- Prós:
- Alta sensibilidade para a detecção.
- Contras:
- Não é viável para um grande número de amostras.
- Os resultados dependem do isolado viral utilizado no teste.
- A confiabilidade depende muito da habilidade dos técnicos e varia significativamente entre os laboratórios.
Interpretação de resultados:
PCR
- Positivo: o vírus está presente. A vacinação recente com um vírus vivo modificado pode dar resultados positivos de PCR. Grandes quantidades de vírus são eliminadas após a infecção (valores de Ct muito baixos; dígito único), especialmente em suínos jovens. O descarte e a contaminação ambiental podem ocorrer durante um longo período de tempo.
Tabela 1. Suínos infectados liberam grandes quantidades de vírus nas fezes (valores de Ct de um dígito em PCR), resultando em extensa contaminação ambiental.
| PED PCR Ct x número de cópias genômicas | |
|---|---|
| 42 | 1 |
| 39 | 10 |
| 36 | 100 |
| 32 | 1000 |
| 29 | 10 000 |
| 26 | 100 000 |
| 22 | 1 000 000 |
| 19 | 10 000 000 |
| 16 | 100 000 000 |
| 12 | 1 000 000 000 |
| 9 | 10 000 000 000 |
| 6 | 100 000 000 000 |
- Negativo: negativo ou o vírus não é detectado se o teste for realizado muito depois da infecção.
ELISA
- Positivo: anticorpos maternos ou exposição prévia (geralmente > 7-14 dias) à vacina ou vírus de campo.
- Negativo: negativo, infecção muito recente para ser detectada (geralmente deve ocorrer pelo menos 7 a 14 dias após a exposição) ou muito tempo se passou após a infecção (especialmente se a IgG sérica for medida).
IHC
- Positivo: o vírus está presente no local da lesão.
Negativo: negativo ou infecção muito antiga para detectar o vírus.
IFA
- Positivo: anticorpos maternos ou exposição prévia (geralmente > 7-14 dias) à vacina ou vírus de campo.
Negativo: negativo para vacina ou vírus de campo ou infecção muito recente para ser detectada (normalmente deve ocorrer pelo menos 7 a 14 dias após a exposição).
Casos clínicos
Diarreia em leitões com mortalidade muito elevada na sala de maternidade
- Coletar intestinos de 2 a 5 leitões para histologia e testes IHC.
- Coletar intestinos ou conteúdo fecal/esfregaços de 5 leitões e analisá-los como 1 pool por PCR.
Primíparas com diarreia +/- vómitos
- Coletar fluídos orais de 2 a 4 baias diferentes e analisar individualmente por PCR. Não agrupe amostras para teste.
- Coletar 10-15 esfregaços retais de matrizes com sinais clínicos ou colher amostras aleatórias e analisá-las por PCR. Os pools podem ser feitos em grupos de 5 para PCR.
Testar leitoas isoladas após exposição ao vírus PED vivo antes da introdução na granja de reprodução
- Os testes não são recomendados porque a contaminação ambiental será alta e as fêmeas apresentarão resultados positivos nas fezes ou fluidos orais durante várias semanas, mesmo depois de terem parado de espalhar o vírus e ser seguro introduzi-las na granja de reprodução.
Suínos de terminação com diarreia aguda pós-desmame
- Coletar fluídos orais de 2 a 4 baias diferentes e analisar individualmente por PCR. Não agrupe amostras para teste.
- Coletar 10-15 esfregaços retais de fêmeas com sinais clínicos ou colher amostras aleatórias e analisá-las por PCR. Os pools podem ser feitos em grupos de 5 para PCR.




